Что такое трансмиссия боли
Ноцицепция включает четыре физиологических процесса: трансдукцию, трансмиссию, модуляцию, перцепцию.
Трансдукция. Начальным ли самым периферическим, звеном системы восприятия боли является раздражение рецепторов, специализирующихся на предупреждении организма о повреждении — ноцицепторов (болевых рецепторов), представляющих собой свободные нервные окончания афферентных волокон. Ноцицепторы находятся в основном в адвентиции мелких сосудов, эндоневрии и соединительной ткани, образуют сплетения в тканях кожи, мышц и некоторых органов, подвергающихся механическому воздействию или ишемии.
В ответ на повреждение или разрушение клеточного субстрата усиливается образование и выделение биологически активных веществ, являющихся возбудителями ноцицепторов. Порог возбуждения ноцицепторов для разных агентов различен. Вместе с тем чувствительность рецепторов заметно увеличивается ко всем агентам при воспалении тканей.
Трансмиссия— процесс проведения возникших при трансдукции импульсов по системе чувствительных нервов. Передача ноцицептивной информации от ноцицепторов в ЦНС осуществляется путем активации рецепторов возбуждающих аминокислот — NMDA (М-метил-D-аспартат), избыточно выделяющихся при действии ноцицептивных раздражителей.
Невральные проводящие пути, обеспечивающие трансмиссию, сформированы из трех компонентов:
• первичный чувствительный афферентный нейрон, доходящий до спинного мозга;
• восходящий промежуточный нейрон, простирающийся от спинного мозга до стволовой части головного мозга и таламуса;
• таламокортикальные проекции.
Модуляция и перцепция.Модуляция — процесс, при котором ноцицептивная трансмиссия модифицируется под влиянием невральных воздействий.
Перцепция — финальный процесс, при котором трансдукция, трансмиссия и модуляция, взаимодействуя с индивидуальными физиологическими особенностями личности, создают конечное субъективное эмоциональное ощущение, воспринимаемое человеком как боль. Таким образом развитие ОБС всегда связано с первичным повреждением тканей. В зависимости от вида повреждающего агента (термический, химический, механический и др.) возбуждаются специфические периферические нервные окончания(ноцицепторы),этот процесс,как упомятнутый раннее, получил название трансдукция. Они трансформируют энергию повреждающего фактора в импульсные потоки, которые передаются в ЦНС(трансмиссия), что в конечном итоге вызывает ощущение боли(модуляция и перцепция).
Важнейшее значение в формировании боли принадлежит биологически активным веществам (БАВ), высвобождающимся из поврежденных тканей. Это брадикинин,
Который появляется в крови в течение нескольких секунд после повреждения капилляров, серотонин, гистамин и др.
ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОСТРОГО БОЛЕВОГО СИНДРОМА
Лечение боли включает фармакологические (наркотические и ненаркотические анальгетики, местные анестетики, адъюванты) , психологические (аутотренинг, гипноз, медитация, расслабление, электросон и др.), физические (холод/тепло, массаж, физиотерапия, электростимуляция, рефлекторная терапия) методы и способы обезболивания.
При проведении обезболивающей терапии у пациентов, независимо от характера травмы и повреждающего агента, необходимо решить следующие задачи:
· оценить степень и выраженность исходного болевого синдрома;
· осуществить первичный выбор медикаментозной или немедикаментозной терапии;
· осуществлять динамический контроль эффективности обезболивания;
· быть готовым к изменению характера обезболивающей терапии (при неэффективности первично выбранных схем лечения).
Одним из факторов, определяющих и обеспечивающих эффективность обезболивающей терапии, является динамическая оценка интенсивности болевого синдрома на протяжении всего периода лечения пациента.
К сожалению, на сегодняшний день не существует объективных методов оценки болевого синдрома, которые бы позволяли независимо от пациента оценить ее интенсивность. Большинство методов требуют участия пациента, анализа его собственных (субъективных) ощущений.

! Наиболее сложна оценка выраженности болевого синдрома у больных в бессознательном состоянии. Отсутствие сознания не означает отсутствие боли!
Методы оценки болевых ощущений можно условно разделить на две группы: «субъективные» и «субъективно-объективные». В рутинной клинической практике наибольшее применение нашли субъективные методы оценки болевых ощущений.
Визуальная аналоговая шкала (ВАШ) оценки интенсивности болевого синдрома. Шкала представляет собой линию длиной 10 см (рис. 2.1), взятую за 10 баллов. Обратная сторона шкалы имеет цену деления, равную 1 мм. Пациент отмечает на лицевой стороне шкалы степень своих болевых ощущений, на обратной стороне — эти ощущения трансформируются в мм/баллы:
0 баллов — пациент полностью удовлетворен своим состоянием — боль отсутствует;
Баллов — пациент не удовлетворен своим состоянием — невыносимая боль.
Оценка интенсивности болевого синдрома в баллах. В настоящее время существует несколько схем оценки болевого синдрома по балльной градации. Самая простая из них представлена в табл. 2.1
Рис. 2.2. Визуальная аналоговая шкала для оценки интенсивности болевого синдрома в баллах
| балл | |||||
| боль | боли нет | слабая боль | Умеренная боль | сильная боль | очень сильная боль |


Рис. 2.2. Визуальная аналоговая шкала для оценки интенсивности болевого синдрома
Что такое трансмиссия боли
2. Трансмиссия — распространение ноцицептивного кода по системе чувствительных нервов.
Невральные проводящие пути, обеспечивающие трансмиссию, сформированы из трех компонентов:
1) первичный чувствительный афферентный нейрон, доходящий до спинного мозга;
2) восходящий промежуточный нейрон, простирающийся от спинного мозга до стволовой части головного мозга и таламуса;
3) таламокортикальные проекции.
В результате исследований, начатых в 50-х годах Рекседом, выяснено, что спинной мозг по своей ультраструктуре разделяется на ряд слоев, называемых пластинами (рис. 13), В пластинах, называемых еще пластинами Рекседа, находятся как возбуждающие, так и тормозящие промежуточные нейроны, а также передающие клетки, транслирующие ноцицептивный код в ростральные отделы мозга.
Часть нейронов в этих пластинах реагирует только на ноциогенные стимулы, другие восприимчивы к широкому спектру стимулов. Волокна типа Аб и С входят в спинной мозг в вентральном боковом участке заднего корешка, вступая затем в состав тракта Лиссауэра и заканчиваясь синапсами в пластинах I, II и V.
Основным путем передачи болевой информации в направлении коры головного мозга является спинно-таламический путь. В свою очередь, он подразделяется на неоспинно-тала-мический и палеоспинно-таламический (Albe-Fessard D., Fessard А., 1975; Belanger A.Y., 1985).
Тела клеток спинно-таламического пути расположены преимущественно в пластинах I и V, а также VII и VIII. Восходящие аксоны этих нейронов проходят в передне-боковых канатиках спинного мозга. На уровне таламуса из этого квадранта выделяются два разных типа проводящих путей. Латеральная их часть (неоспинно-таламический путь) образует синапсы в латеральном отделе таламуса, откуда сигналы проецируются в соматосенсорную зону коры.
Латеральный спинно-таламический путь обеспечивает сенсорно-дискриминантные аспекты болевой перцепции. Неоспинно-таламический путь, филогенетически более молодой, состоит из длинных волокон, расположенных в наружных отделах спинно-таламического пути.
Четкая сомато-топическая организация позволяет ему осуществлять передачу болевой и тактильной информации о положении периферического стимула в пространстве и времени, его интенсивности и продолжительности, т.е. дискриминационные аспекты боли. Через него в основном осуществляется передача острой (хорошо локализованной) боли. Неоспинно-таламический путь заканчивается в ядрах вентролатерального и заднего таламуса, тесно связанных с первой и второй сомато-сенсорными зонами коры.
Медиальный спинно-таламический (палеоспинно-таламический) путь образует многочисленные синапсы в ретикулярной формации ствола мозга, в медиальном отделе таламуса, в периакведуктальном сером веществе и в гипоталамусе. Последующая проекция происходит диффузно в разные зоны коры и в лимбическую систему, принимает участие в передаче информации и формировании ощущения тупой, слабо локализованной хронической боли, т.е. недискриминантных ее аспектов.
В связи с широким распространением окончаний в медиальных и интраламинарных ядрах таламуса, а также гипоталамуса, структурах лимбического комплекса спинно-таламический путь приспособлен для формирования разнообразных супрасегментарных рефлекторных ответов, включающих изменение дыхания, кровообращения, эндокринных функций, мотивационно-поведенческие и сложные защитные функции.
Кроме того, полагают, что импульсная активность в палеоспинно-таламическом пути активирует нисходящую систему подавления боли, связанную с эндогенными агентами (Belanger A.Y., 1985). Таким образом, медиальный спинно-таламический путь обеспечивает аффективно-мотивационные аспекты болевой перцепции.
Следовательно, спинно-таламический путь через вентробазальные ядра таламуса образует специфическую систему боли, а через интраламинарные и медиальные ядра — неспецифическую. Разрушение первых образований проявляется в клинике аналгезией и нарушением дискриминационной чувствительности, разрушение вторых — крайне мучительными с оттенком жжения «таламическими» болями в контралатеральной половине туловища, лица, дистальных отделов конечностей. Считается, что таламус является конечной «станцией» переключения болевой импульсации (Comelli Е, 1975).
Волокна третьего нейрона всех видов чувствительности идут от таламуса через заднюю ножку внутренней капсулы к задней центральной извилине и к верхней теменной дольке. По данным В.К.Решетняка и соавт. (1986), первая соматосенсорная зона связана с тонким дискриминационным анализом соматической чувствительности и участвует в восприятии боли.
Вторая сенсомоторная зона отвечает за первичный ситуационный анализ и связана с регуляцией двигательного ответа на боль. Примечательно, что разрушение первой зоны приводит к повышению порога болевой чувствительности на противоположной стороне, а разрушение второй, напротив, снижает порог болевой чувствительности. Болевая афферентация может поступить в головной мозг непосредственно через чувствительные клетки основания заднего рога, которые соединяются между собой вставочными нейронами (клетки-передатчики)
Известен также «окольный» путь передачи боли вначале через пограничную симпатическую цепочку, а затем в верхних ее отделах болевое возбуждение вступает в спинной мозг через задние корешки. По данным R.Melzak и P.Wall (1965), одним из модуляторов болевого раздражения могут быть задние столбы спинного мозга. Кроме этого установлено, что на всех релейных участках передачи болевых импульсов (в первичных болевых афферентах, задних рогах спинного мозга, таламусе, лимбико-ретикулярном комплексе, в небольших количествах в коре головного мозга) обнаружено наличие нейропептида — субстанции Р — (pain — боль).
Субстанция Р(состоит из 11 аминокислот) и может быть передатчиком болевых стимулов. Вещество Р выделяется только при интенсивном болевом воздействии. Субстанция Р может взаимодействовать и с катехоламинами, она обладает способностью защищать организм от стрессов, может вызывать снижение АД (Oehme Р. е.а., 1986).
Таким образом, процесс трансмиссии связан с вовлечением в ноцицепцию самых различных отделов нервной системы. Однако в узловых местах нейронная сеть меняет характеристики ноцицептивного кода и соответственно сам процесс формирования феномена боли.
Модуляция
3. Модуляция — это процесс, при котором ноцицептивная информация модифицируется при трансмиссии по ноцицептивной системе.
Издавна обращалось внимание на то, что повреждения одинаковой тяжести вызывают у разных лиц резко различающиеся по степени выраженности болевые ощущения в зависимости от физиологических, ситуационных, этнических, культурных и других факторов.
Травма на поле боя может сопровождаться значительно меньшими болями по сравнению с подобными же повреждениями в обычных условиях. У ряда больных введение физиологического раствора может обеспечить выраженное обезболивание. Все это говорит о том, что ЦНС способна модулировать боль, и механизмы этого процесса в последние годы начали выясняться.
Reynolds (1969) первым описал глубокую аналгезию у крыс во время электрической стимуляции центрального серого вещества, окружающего водопровод мозга.
Другим механизмом модуляции является наличие эндогенных опиоидов. Многие зоны мозга у человека и животных способны при стимуляции вызывать аналгезию. Обнаружено, что такие участки совпадают или перекрывают зоны мозга с повышенной концентрацией эндогенных опиоидных нейротрансмиттеров.
Многочисленные исследования не выявили каких-либо отличий в структуре, физиологии и фармакологии при аналгезии, вызванной стимуляцией или назначением опиоидов. Введение минимальных количеств морфина в зоны мозга, раздражение которых продуцировало аналгезию, вызывало выраженное обезболивание.
Важными центрами нисходящей модулирующей системы являются перивентрикулярное и периакведуктальное скопление серого вещества, дорсолатеральный отдел моста, ядро шва и ростровентральный отдел продолговатого мозга. Биогенные амины (серотонин и норадреналин), так же как и эндогенные опиоиды, представляют собой нейротрансмиттеры этой системы. Антиноцицептивные системы оказывают существенное влияние на модуляцию.
Указанные выше процессы имеют механический характер и не отличаются от процессов, лежащих в основе любого другого вида восприятия. Они составляют один из компонентов сенсорно-дискриминативных аспектов боли.
Теория боли — ноцицептивные системы. Трансмиссия

Трансмиссия
2. Трансмиссия — распространение ноцицептивного кода по системе чувствительных нервов.
Невральные проводящие пути, обеспечивающие трансмиссию, сформированы из трех компонентов:
1) первичный чувствительный афферентный нейрон, доходящий до спинного мозга;
2) восходящий промежуточный нейрон, простирающийся от спинного мозга до стволовой части головного мозга и таламуса;
3) таламокортикальные проекции.
В результате исследований, начатых в 50-х годах Рекседом, выяснено, что спинной мозг по своей ультраструктуре разделяется на ряд слоев, называемых пластинами (рис. 13), В пластинах, называемых еще пластинами Рекседа, находятся как возбуждающие, так и тормозящие промежуточные нейроны, а также передающие клетки, транслирующие ноцицептивный код в ростральные отделы мозга.
Часть нейронов в этих пластинах реагирует только на ноциогенные стимулы, другие восприимчивы к широкому спектру стимулов. Волокна типа Аб и С входят в спинной мозг в вентральном боковом участке заднего корешка, вступая затем в состав тракта Лиссауэра и заканчиваясь синапсами в пластинах I, II и V.
Основным путем передачи болевой информации в направлении коры головного мозга является спинно-таламический путь. В свою очередь, он подразделяется на неоспинно-тала-мический и палеоспинно-таламический (Albe-Fessard D., Fessard А., 1975; Belanger A.Y., 1985).
Тела клеток спинно-таламического пути расположены преимущественно в пластинах I и V, а также VII и VIII. Восходящие аксоны этих нейронов проходят в передне-боковых канатиках спинного мозга. На уровне таламуса из этого квадранта выделяются два разных типа проводящих путей. Латеральная их часть (неоспинно-таламический путь) образует синапсы в латеральном отделе таламуса, откуда сигналы проецируются в соматосенсорную зону коры.
Латеральный спинно-таламический путь обеспечивает сенсорно-дискриминантные аспекты болевой перцепции. Неоспинно-таламический путь, филогенетически более молодой, состоит из длинных волокон, расположенных в наружных отделах спинно-таламического пути.
Четкая сомато-топическая организация позволяет ему осуществлять передачу болевой и тактильной информации о положении периферического стимула в пространстве и времени, его интенсивности и продолжительности, т.е. дискриминационные аспекты боли. Через него в основном осуществляется передача острой (хорошо локализованной) боли. Неоспинно-таламический путь заканчивается в ядрах вентролатерального и заднего таламуса, тесно связанных с первой и второй сомато-сенсорными зонами коры.
Медиальный спинно-таламический (палеоспинно-таламический) путь образует многочисленные синапсы в ретикулярной формации ствола мозга, в медиальном отделе таламуса, в периакведуктальном сером веществе и в гипоталамусе. Последующая проекция происходит диффузно в разные зоны коры и в лимбическую систему, принимает участие в передаче информации и формировании ощущения тупой, слабо локализованной хронической боли, т.е. недискриминантных ее аспектов.
В связи с широким распространением окончаний в медиальных и интраламинарных ядрах таламуса, а также гипоталамуса, структурах лимбического комплекса спинно-таламический путь приспособлен для формирования разнообразных супрасегментарных рефлекторных ответов, включающих изменение дыхания, кровообращения, эндокринных функций, мотивационно-поведенческие и сложные защитные функции.
Кроме того, полагают, что импульсная активность в палеоспинно-таламическом пути активирует нисходящую систему подавления боли, связанную с эндогенными агентами (Belanger A.Y., 1985). Таким образом, медиальный спинно-таламический путь обеспечивает аффективно-мотивационные аспекты болевой перцепции.
Следовательно, спинно-таламический путь через вентробазальные ядра таламуса образует специфическую систему боли, а через интраламинарные и медиальные ядра — неспецифическую. Разрушение первых образований проявляется в клинике аналгезией и нарушением дискриминационной чувствительности, разрушение вторых — крайне мучительными с оттенком жжения «таламическими» болями в контралатеральной половине туловища, лица, дистальных отделов конечностей. Считается, что таламус является конечной «станцией» переключения болевой импульсации (Comelli Е, 1975).
Волокна третьего нейрона всех видов чувствительности идут от таламуса через заднюю ножку внутренней капсулы к задней центральной извилине и к верхней теменной дольке. По данным В.К.Решетняка и соавт. (1986), первая соматосенсорная зона связана с тонким дискриминационным анализом соматической чувствительности и участвует в восприятии боли.
Вторая сенсомоторная зона отвечает за первичный ситуационный анализ и связана с регуляцией двигательного ответа на боль. Примечательно, что разрушение первой зоны приводит к повышению порога болевой чувствительности на противоположной стороне, а разрушение второй, напротив, снижает порог болевой чувствительности. Болевая афферентация может поступить в головной мозг непосредственно через чувствительные клетки основания заднего рога, которые соединяются между собой вставочными нейронами (клетки-передатчики)
Известен также «окольный» путь передачи боли вначале через пограничную симпатическую цепочку, а затем в верхних ее отделах болевое возбуждение вступает в спинной мозг через задние корешки. По данным R.Melzak и P.Wall (1965), одним из модуляторов болевого раздражения могут быть задние столбы спинного мозга. Кроме этого установлено, что на всех релейных участках передачи болевых импульсов (в первичных болевых афферентах, задних рогах спинного мозга, таламусе, лимбико-ретикулярном комплексе, в небольших количествах в коре головного мозга) обнаружено наличие нейропептида — субстанции Р — (pain — боль).
Субстанция Р(состоит из 11 аминокислот) и может быть передатчиком болевых стимулов. Вещество Р выделяется только при интенсивном болевом воздействии. Субстанция Р может взаимодействовать и с катехоламинами, она обладает способностью защищать организм от стрессов, может вызывать снижение АД (Oehme Р. е.а., 1986).
Таким образом, процесс трансмиссии связан с вовлечением в ноцицепцию самых различных отделов нервной системы. Однако в узловых местах нейронная сеть меняет характеристики ноцицептивного кода и соответственно сам процесс формирования феномена боли.
Модуляция
3. Модуляция — это процесс, при котором ноцицептивная информация модифицируется при трансмиссии по ноцицептивной системе.
Издавна обращалось внимание на то, что повреждения одинаковой тяжести вызывают у разных лиц резко различающиеся по степени выраженности болевые ощущения в зависимости от физиологических, ситуационных, этнических, культурных и других факторов.
Травма на поле боя может сопровождаться значительно меньшими болями по сравнению с подобными же повреждениями в обычных условиях. У ряда больных введение физиологического раствора может обеспечить выраженное обезболивание. Все это говорит о том, что ЦНС способна модулировать боль, и механизмы этого процесса в последние годы начали выясняться.
Reynolds (1969) первым описал глубокую аналгезию у крыс во время электрической стимуляции центрального серого вещества, окружающего водопровод мозга.
Другим механизмом модуляции является наличие эндогенных опиоидов. Многие зоны мозга у человека и животных способны при стимуляции вызывать аналгезию. Обнаружено, что такие участки совпадают или перекрывают зоны мозга с повышенной концентрацией эндогенных опиоидных нейротрансмиттеров.
Многочисленные исследования не выявили каких-либо отличий в структуре, физиологии и фармакологии при аналгезии, вызванной стимуляцией или назначением опиоидов. Введение минимальных количеств морфина в зоны мозга, раздражение которых продуцировало аналгезию, вызывало выраженное обезболивание.
Важными центрами нисходящей модулирующей системы являются перивентрикулярное и периакведуктальное скопление серого вещества, дорсолатеральный отдел моста, ядро шва и ростровентральный отдел продолговатого мозга. Биогенные амины (серотонин и норадреналин), так же как и эндогенные опиоиды, представляют собой нейротрансмиттеры этой системы. Антиноцицептивные системы оказывают существенное влияние на модуляцию.
Указанные выше процессы имеют механический характер и не отличаются от процессов, лежащих в основе любого другого вида восприятия. Они составляют один из компонентов сенсорно-дискриминативных аспектов боли.
Современный взгляд на теорию боли. Методы лечения боли.
Клиника экспериментальной терапии РОНЦ им. Н.Н. Блохина РАМН с ООО «Биоконтроль»
«Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии – ВИТАР»
к.б.н. Корнюшенков Е.А.
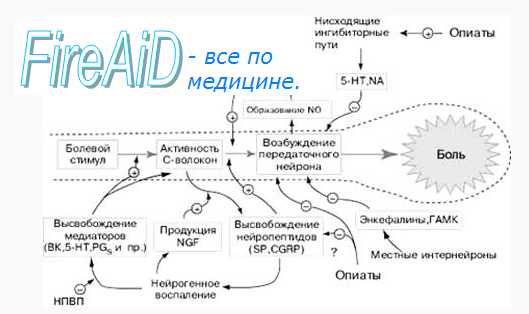
Боль – понятие клиническое и патогенетически сложное. Боль определяют как «неприятное ощущение и эмоциональное испытание, связанное с имеющимся или потенциальным повреждением тканей, либо же испытываемое в момент этого повреждения» (М. Ферранте 2001). Между местом повреждения и моментом восприятия боли лежит целая серия сложных электрохимических явлений, объединенных термином «ноцицепция». Ноцицепция включает четыре физиологических процесса:
Трансдукция – процесс, при котором повреждающее воздействие трансформируется в виде электрической активности на окончаниях чувствительных нервов.
Трансмиссия – проведение нервных импульсов по системе чувствительных нервов.
Модуляция – это процесс, при котором ноцицептивная трансмиссия модифицируется под влиянием невральных воздействий.
Перцепция – является финальным процессом, при котором трансдукция, трансмиссия и модуляция, взаимодействуя с индивидуальными физиологическими особенностями, создают конечное субъективное эмоциональное ощущение, воспринимаемое как боль.
Традиционно рассматриваются две основные теории болевого восприятия. Согласно первой, выдвинутой M. Frey, в коже имеются болевые рецепторы, от которых начинаются специфические афферентные пути к головному мозгу. Было показано, что при раздражении кожи человека с помощью металлических электродов, прикосновение которых даже не ощущалось, выявлялись «точки», пороговая стимуляция которых воспринималось как резкая нестерпимая боль. Вторая теория, предложенная Goldscheider, говорит о том, что любой сенсорный стимул, достигающий определенной интенсивности, может вызвать боль. Другими словами, не существует специфических болевых структур, а боль является результатом суммации термических, механических и других сенсорных импульсов. Названная вначале теория интенсивности, позже она стала более известна как теория «паттерна» или «суммации». Однако исследования последних лет, посвященные изучению анатомии и физиологии боли, в большой степени «примирили» эти две оппозиционных теории.
В настоящее время установлено, что существует два типа периферических дистальных сенсорных нейронов, наиболее активно реагирующих на ноцицептивные стимулы. Первый тип – это очень тонкие, слабомиелинизированные, так называемые С — волокна (0.4-1.1 мкм в диаметре), вторые – тонкие, миелинизированные А – дельта волокна (1-5 мкм в диаметре). Согласно современным данным, периферические рецепторы этих нейронов в большом количестве в различных тканях и органах и имеют множество концевых разветвлений с мелкими акзоплазматическими отростками, которые и являются структурами, активируемыми болевым воздействием. На основании изучения ответных характеристик этих тонких афферентов было выделено три их вида: механосенситивные, термосенситивные и полимодальные ноцицепторы.
С активацией афферентных волокон определенного типа связывают различные виды болевых ощущений: так называемую первичную – коротколатентную, хорошо локализованную и качественно детерминированную боль, и вторичную – длиннолатентную, плохо локализованную, тягостную, тупую боль. Экспериментально установлено, что «первичная» боль связана с афферентной импульсацией в А–волокнах, а «вторичная» — с С–волокнами. Однако А–дельта С-волокна не являются исключительно проводниками болевой чувствительности, они активируются также неповреждающими термическими (тепловыми, холодовыми) и механическими (прикосновение, небольшое сдавление) стимулами.
Антиноцицептивная система
В формирование финального болевого ощущения существенную роль играют антиноцицептивные системы (АС). Так же, как ноцицептивные, АС формируются на разных уровнях нервной системы. Первое звено АС представлено воротным контролем боли на уровне заднего рога спинного мозга. Усиление активности толстых миелиновых сенсорных волокон тормозит передачу ноцицептивной передачи. На этом основаны анальгетические эффекты чрескожной электронейростимуляциии других стимуляционных воздействий, способствующих усилению афферентации по хорошо миелинизированным толстым сенсорным волокнам. Если болепроводящие восходящие пути были известны уже достаточно давно, то нисходящие пути, контролирующие боль, изучены относительно недавно.
Другой АС является система нисходящих связей ядер ретикулярной формации ствола головного мозга. По некоторым данным, стимуляция ретикулярных ядер ствола в значительно большой степени, чем раздражение ядер шва, угнетает передачу ноцицептивной информации в спинном мозге.
Медиаторы АС
Существенным механизмом контроля боли являются эндогенные опиатные системы. Опиатные рецепторы обнаружены в терминальных тонких А — дельта и С – волокон, в нейронах задних рогов спинного мозга, в ретикулярных ядрах ствола головного мозга, таламусе, лимбической системе. В последнее время идентифицированы нейропептиды (эндорфины, энкефалины), обладающие специфическим морфиноподобным действием на эти рецепторы, обеспечивающие анальгетический эффект при высвобождении из депозитов и, присоединяясь к специфическим рецепторам
нейронов, вовлеченных в передачу нервных импульсов. Их высвобождение может быть стимулировано как периферическими ноцицептивными, так и исходящими, контролирующими боль системами.
Методы оценки болевого синдрома
В ветеринарии, как и в педиатрии это наименее изученный вопрос. Тот факт что животные и дети не могут объективно рассказать о степени боли, ее локализации заставляет клиницистов применять различные визуально-аналоговые шкалы. Как правило, они представляют собой некую оценку клинических симптомов, по которым врач может судить испытывает ли пациент болевой симптом или нет. Одна из таких шкал была представлена на рассмотрение в институте боли в Глазго (шкала M.Gilla). Она включала в себя следующие моменты: врач оценивал позу животного; звуковое выражение боли; реакцию на прикосновение к животному; общее поведение животного; внимание животного к ране (достоверность ошибки данного вида оценки составляет, по мнению авторов 10-20%).
Другим методом оценки (или дополнительным методом) могут служить данные о характере оперативного вмешательства (Таб.1).
Таблица 1. Ожидаемая степень боли, вызванная хирургической операцией.
| Ожидаемая степень боли | Тип хирургического вмешательства | Средняя продолжительность боли (в баллах) |
| Умеренная | Маленькие н/о кожи | 0.5 — 1.0 |
| Умеренно выраженная | Большие опухоли кожи, мастэктомия, рутинная стоматология | 1.5 — 3.0 |
| Выраженная | Артротомия, каудальная абдоминальная хирургия, грудино-поясничный уровень при ламинэктомии | 3.0- 4.0 |
| Средней тяжести | Травматология и ортопедия, абдоминальная хирургия, овариогистерэктомия | 3.0 – 6.0 |
| Тяжелая | Нейрохирургия головы и шей, офтальмология, ТРНСП, ринотомия, торакальная хирургия | 4.0 – 8.0 |
Методы лечения боли
К группам препаратов способных блокировать болевой синдром относятся:
- Наркотические анальгетики
- Ненаркотические анальгетики
- Нестероидные противовоспалительные препараты
- Местные анестетики
- Глюкокортикостероиды
- Спазмолитики
- Ингибиторы факторов воспаления
Мы рассмотрим лишь некоторые группы.
Механизм действия наркотических анальгетиков (опиоидов) не достаточно изучен. Считается, что опиоиды способствуют образованию нейропептидов (эндорфинов, энкефалинов), которые образуют лиганд с опиоидными рецепторами тем самым ликвидируя болевой синдром.
По своей активности на опиоидные рецепторы наркотические анальгетики классифицируются на полные агонисты (морфин, фентанил, промедол), частичные агонисты или агонист-антагонисты (буторфанол, трамадол, налбуфин), и полные антагонисты (налаксон).
К данной группе препаратов широко используемых в ветеринарии относятся анальгетики-антиперетики (анальгин) и нестероидные противовоспалительные препараты (НПВП). Как правило, лечение данной группой препаратов используется при лечении слабовыраженного болевого синдрома или в случаях хронического болевого синдрома (НПВП при остеоартрозах).
Достаточно часто используются в качестве средств для регионарного введения, а также в режиме постоянной контролируемой инфузии (CR – Infusion). Наиболее часто используют такие препараты как лидокаин 2%, 10%, бупивакаин 0.5% и ропивакаин 0.75%. Особенность проявляется при использовании местных анестетиков у кошек. Кошки наиболее подвержены токсическим явлениям. Они проявляются у них беспокойством, гиперсаливацией, седацией, рвотой. Поэтому методику внутривенного применения постоянной контролируемой инфузии у этого вида животных стараются не применять.
Что такое трансмиссия боли
Боль. Болевая чувствительность. Ноцицепторы. Пути болевой чувствительности. Оценка боли. Ворота боли. Опиатные пептиды.
Боль определяется как неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения. В отличие от других сенсорных модальностей боль всегда субъективно неприятна и служит не столько источником информации об окружающем мире, сколько сигналом повреждения или болезни. Болевая чувствительность побуждает к прекращению контактов с повреждающими факторами среды.
Болевые рецепторы или ноцицепторы представляют собой свободные нервные окончания, расположенные в коже, слизистых оболочках, мышцах, суставах, надкостнице и во внутренних органах. Чувствительные окончания принадлежат либо безмякотным, либо тонким миелинизиро-ванным волокнам, что определяет скорость проведения сигналов в ЦНС и дает повод к различению ранней боли, короткой и острой, возникающей при проведении импульсов с большей скоростью по миелиновым волокнам, а также поздней, тупой и длительной боли, в случае проведения сигналов по безмякотным волокнам. Ноцицепторы относятся к полимодальным рецепторам, поскольку могут активироваться стимулами разной природы: механическими (удар, порез, укол, щипок), термическими (действие горячих или холодных предметов), химическими (изменение концентрации ионов водорода, действие гистамина, брадикинина и ряда других биологически активных веществ). Порог чувствительности ноцицепторов высок, поэтому лишь достаточно сильные стимулы вызывают возбуждение первичных сенсорных нейронов: например, порог болевой чувствительности для механических стимулов примерно в тысячу раз превышает порог тактильной чувствительности.
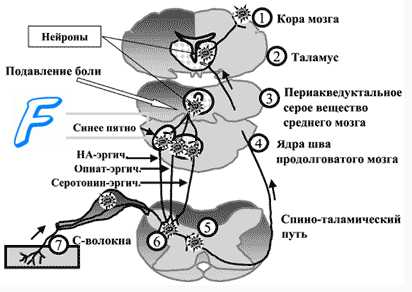
Центральные отростки первичных сенсорных нейронов входят в спинной мозг в составе задних корешков и образуют синапсы с нейронами второго порядка, расположенными в задних рогах спинного мозга. Аксоны нейронов второго порядка переходят на противоположную сторону спинного мозга, где образуют спиноталамический и спиноретикулярный тракты. Спиноталамический тракт оканчивается на нейронах нижнего заднелате-рального ядра таламуса, где происходит конвергенция проводящих путей болевой и тактильной чувствительности. Нейроны таламуса образуют проекцию на соматосенсорную кору: этот путь обеспечивает осознаваемое восприятие боли, позволяет определять интенсивность стимула и его локализацию.
Волокна спиноретикулярного тракта оканчиваются на нейронах ретикулярной формации, взаимодействующих с медиальными ядрами таламуса. При болевом раздражении нейроны медиальных ядер таламуса оказывают модулирующее влияние на обширные регионы коры и структуры лимбической системы, что приводит к повышению поведенческой активности человека и сопровождается эмоциональными и вегетативными реакциями. Если спиноталамический путь служит для определения сенсорных качеств боли, то спиноретикулярный путь предназначен играть роль сигнала общей тревоги, оказывать на человека общее возбуждающее действие.
Субъективную оценку боли определяет соотношение нейронной активности обоих путей и зависимая от нее активация антиноцицептивных нисходящих путей, способных изменить характер проведения сигналов от ноцицепторов. В сенсорную систему болевой чувствительности встроен эндогенный механизм ее уменьшения путем регуляции порога синаптических переключений в задних рогах спинного мозга («ворота боли»). На передачу возбуждения в этих синапсах влияют нисходящие волокна нейронов серого вещества вокруг водопровода, голубого пятна и некоторых ядер срединного шва. Медиаторы этих нейронов (энкефалин, серотонин, норадреналин) тормозят активность нейронов второго порядка в задних рогах спинного мозга, чем уменьшают проведение афферентных сигналов от ноци-цепторов.
Аналгезирующим (обезболивающим) действием обладают опиатные пептиды (дайнорфин, эндорфины), синтезируемые нейронами гипоталамуса, которые имеют длинные отростки, проникающие в другие отделы головного мозга. Опиатные пептиды присоединяются к специфическим рецепторам нейронов лимбической системы и медиальной области таламуса, их образование увеличивается при некоторых эмоциональных состояниях, стрессе, продолжительных физических нагрузках, у беременных женщин незадолго перед родами, а также в результате психотерапевтического воздействия или акупунктуры. В результате повышенного образования опиатных пептидов активируются антиноцицептивные механизмы и повышается порог болевой чувствительности. Баланс между ощущением боли и ее субъективной оценкой устанавливается с помощью лобных областей мозга, участвующих в процессе восприятия болевых стимулов. При поражении лобных долей (например, в результате травмы или опухоли) порог болевой чувствительности не изменяется и поэтому сенсорный компонент болевого восприятия сохраняется неизменным, однако субъективная эмоциональная оценка боли становится иной: она начинает восприниматься лишь как сенсорное ощущение, а не как страдание.
Боль в спине: как справиться с ней через работу с мыслями
Причины неприятных ощущений часто кроются в психике. Недавнее исследование показало, что «терапия переработки боли» неплохо работает

Что бы вы сказали, если бы при боли в спине вместо массажа и обезболивающих вам предложили «переосмыслить» свои ощущения? Нет, это не глупая шутка, а реальный терапевтический инструмент, который иногда может посоперничать по эффективности с обезболивающими. Боль в спине — не только очень распространенная проблема, но и одно из самых ярких проявлений тесного взаимодействия психики и соматики. Примерно в 85% случаев установить ее причины не удается: нервы не защемлены, позвонки целы, межпозвоночная грыжа на спинной мозг не давит, очага острого воспаления нет. Как нет и надежных способов ее снять: часто не помогают даже анальгетики.
В последнее время появляется все больше свидетельств того, что боль в спине может быть психогенной. Один из аргументов в пользу этой теории — результаты клинического эксперимента, который провели недавно ученые из университета Колорадо. Они применили новую методику — «терапию переработки боли» (PRT). И она оказалась эффективнее, чем традиционное лечение и плацебо в контрольных группах. Всего за месяц 73% испытуемых, проходивших по два удаленных сеанса PRT в неделю, избавились или почти избавились от хронической боли в спине. Причем этот эффект сохранился у них как минимум в течение года. Результаты подтверждены объективными замерами, включая компьютерную томографию мозга. Как отмечают авторы работы, преимущество нового метода еще и в том, что его можно без специальной подготовки и риска для здоровья применять самостоятельно. Для тех, кто хочет попробовать, мы перевели описание PRT из приложения к исследованию.
Что такое PRT и как это работает
В терапии переработки боли пять основных компонентов. Чтобы взять болевые ощущения под контроль, необходимо: 1) понять, что боль возникает в мозге и это обратимая реакция; 2) убедиться в происхождении и обратимости боли на собственном опыте; 3) научиться оценивать болевые ощущения с точки зрения их реальной опасности для здоровья; 4) решить сопутствующие эмоциональные проблемы; 5) переключиться на позитивное восприятие.
1. Происхождение боли, обратимость болевой реакции и цикл боль — страх
Переосмысление боли начинается с понимания того, что это ощущение может возникать даже при отсутствии каких-либо ран, травм и физических нарушений. Боль — это сигнал опасности. Ее главная цель — предотвратить повреждение. Например, если положить ладонь на горячую плиту, боль заставит убрать руку раньше, чем она пострадает от ожога. Проблема в том, что система оповещения об опасности может активироваться и без физического повреждения. Мозг способен интерпретировать даже безобидные сигналы организма как сообщение об угрозе. В этих случаях боль похожа на ложную тревогу. Пожарная сигнализация срабатывает (боль абсолютно реальна), но пожара на самом деле нет (тело не пострадало).
Главный помощник боли — страх. Если человек целиком сосредоточен на болевых ощущениях и сильно напуган ими, мозг получает подтверждающий сигнал: боль опасна. В результате боль приобретает стойкий характер. Так запускается цикл боль — страх:
- боль вызывает страх;
- страх переводит мозг в режим повышенной тревожности, из-за чего боль усиливается;
- чем сильнее боль, тем больше страха;
- чем больше страха, тем сильнее боль.
Чтобы разорвать этот порочный круг, нужно изменить отношение к боли — перестать ее бояться. Когда вы учитесь воспринимать боль без страха, она постепенно теряет силу.
2. Получение корректирующего и подкрепляющего опыта
Если есть уверенность, что боль — это признак болезни или физического повреждения, преодолеть страх перед ней непросто. Поэтому на первом этапе терапии главная цель — осознать, что боль рождается в мозге, а не в теле. Сделать это сложно по трем причинам.
- Биологическая инерция: мы эволюционно запрограммированы на то, чтобы отождествлять боль с физической травмой.
- Ранее поставленный диагноз: у многих пациентов, страдающих от болей в спине, диагностированы реальные физические нарушения (грыжи, дегенерация дисков).
- Заученные ассоциации: у многих людей с хронической болью в спине закрепляется в психике связь между болевыми ощущениями и определенным положением тела (позой стоя или сидя) или видами активности (ходьбой, бегом, наклонами). Эти ассоциации придают дополнительную уверенность в том, что боль вызвана физическими нарушениями.
Один из способов разорвать ментальную связь между болью и предполагаемым физическим нарушением — противопоставить ей как можно больше примеров того, что источник болевых ощущений — не конкретная часть тела, а центральная нервная система в целом. Вот самые наглядные доказательства.
- Боль возникает в момент стресса.
- Боль появляется без физических повреждений.
- Боль носит нестабильный характер.
- Кроме боли есть много других психосоматических симптомов.
- Налицо психологические триггеры боли, например, социальные конфликты.
- Иногда при проблемной физической активности боль не возникает.
Собранные факты, свидетельствующие в пользу психического происхождения боли, полезно объединить в список. Например:
- МРТ показала, что с позвоночником у меня все в порядке.
- У меня бывают другие болевые ощущения такого же типа — мигрени, синдром раздраженного кишечника.
- Спина у меня начала болеть через две недели после того, как я съехался с родителями.
- В рабочие дни боль у меня усиливается, а в выходные становится терпимой.
3. Восприятие и оценка боли с безопасной позиции
Ключевая техника PRT — «соматический трекинг». Цель — помочь пациенту изучить свою боль, сохраняя ощущение безопасности. Соматический трекинг используется и при спонтанной внутренней боли, и в ситуациях, когда болевые ощущения и страх вызваны определенной физической активностью. Например, если пациент испытывает боль, когда сидит, терапевт учит его проводить соматический трекинг в этой позе. Эта техника включает в себя три компонента: 1) осознанность; 2) оценку реальной опасности боли; 3) настрой на позитивное восприятие.
- Осознанность. Изучите свою боль как сторонний наблюдатель. Попробуйте описать свои ощущения как можно точнее. Например, определите, насколько четко и где именно они локализованы. Не пытайтесь отвлечься от боли — просто следите за ней, как за объектом исследования. Для нейтрализации страха одной осознанности часто недостаточно, поэтому обычно она дополняется вторым компонентом соматического трекинга.
- Оценка реальной опасности боли. Самостоятельно или с помощью терапевта настройтесь на восприятие боли как безопасного состояния. Напряжение, резь или жжение — неприятные ощущения, но вашей жизни они не угрожают. Напоминайте себе, что физически вы здоровы. Просто ваш мозг ошибочно интерпретирует сигналы организма как сообщения об опасности. Мы все испытываем разные ощущения, когда напрягаем мышцы спины. Обычно они трактуются мозгом как приятные или нейтральные. Например, если бы вы ощутили похожее жжение в джакузи, оно, скорее всего, доставило бы вам удовольствие. Но сейчас ваш мозг воспринимает это ощущение сквозь призму страха, поэтому оно кажется вам болезненным. На самом же деле ваши мышцы, сухожилия и связки в полном порядке. Переключение к режиму восприятия боли как безопасного ощущения возможно только в том случае, если на предварительном этапе вы собрали достаточно доказательств того, что болевые ощущения — это не обязательно индикатор физического повреждения или нарушения функций организма.
- Настрой на позитивное восприятие. Лучший способ сменить эмоциональный заряд с минуса на плюс — юмор. Терапевты Алан Гордон и Элон Зив приводят в пример такое вмешательство: «Представьте себе, что ваша спина — это море, ваши ощущения — косяк рыб, которыми вы любуетесь, а ваш терапевт — дружелюбная говорящая морская черепаха, плавающая неподалеку».
Соматический трекинг можно практиковать не только под руководством терапевта, но и самостоятельно. Часто именно в процессе отслеживания своих болевых ощущений пациент получает дополнительный корректирующий опыт. Каждый раз, когда вы убеждаетесь, что на самом деле можете сидеть, стоять, ходить или наклоняться с минимальной болью или вообще без боли, у вас растет осознание того, что ваша боль порождена не телом, а мозгом. Это избавляет вас от страха перед физической активностью. И помогает впредь воспринимать боль без тревоги, фрустрации и отчаяния.
4. Решение сопутствующих эмоциональных проблем
В состоянии повышенной тревожности человек склонен воспринимать все происходящее как угрозу. Он вздрагивает от громкого звука, отскакивает от прикосновения, воспринимает любое резкое ощущение в теле как боль. Кроме того, ощущение угрозы может возникать из-за склонности к деструктивным психологическим реакциям — болезненной самокритике, чрезмерным требованиям к себе и мнительности.
Задача PRT — снизить общий уровень напряжения. Способы достижения этой цели — помощь в управлении эмоциями, переработка травматического опыта, осмысление сложных межличностных отношений. По мере снижения общего уровня тревожности и стресса мозг начинает интерпретировать телесные ощущения как безопасные сигналы, что ведет к ослаблению боли. Для вскрытия и переработки проблемных эмоций используются подходящие терапевтические методы (например, терапия эмоционального осознания и экспрессии — EAET).
5. Переориентация на позитивное восприятие
Цель PRT — не только ослабить ощущение опасности, но и усилить общее чувство безопасности. Люди, страдающие от хронической боли, так привыкают фокусироваться на негативных и неприятных телесных ощущениях, что зачастую воспринимают сквозь призму страха и многое другое, включая эмоции и даже свою личность. В широком смысле PRT помогает переключиться из экстремального в спокойный режим. Один из самых доступных способов переключения — концентрация на приятных ощущениях. Например, на дыхании. Попробуйте медленно вдыхать и выдыхать, фокусируясь на чувстве теплоты, прохлады, наполнения и освобождения легких. Практикуя спокойное осознание приятных телесных ощущений, вы заодно тренируете и способность без страха воспринимать неприятные.